ချားလ်စ်၏ နိယာမ
ချားလ်စ်၏ နိယာမ ( law of volume ဟုလည်း သိကြသေးသည်။) သည် ဓာတ်ငွေ့ကို အပူပေးသည့်အခါ မည်သို့ပြန့်သွားသည်ကို လေ့လာစမ်းသပ်မှု ဖြစ်သည်။ ချား၏ နိယာမကို စာသားဖြင့် ဖော်ပြရသော် -
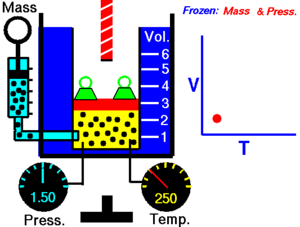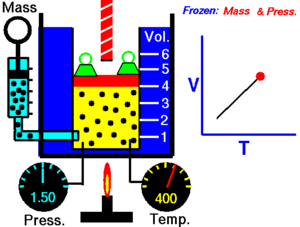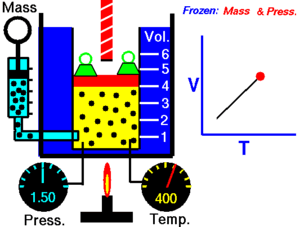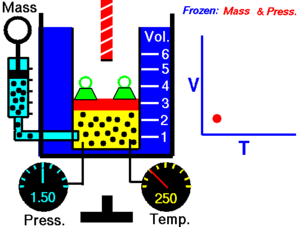
ခြောက်သွေ့သော ဓာတ်ငွေ့တွင် သက်ရောက်နေသောဖိအားသည် ကိန်းသေဖြစ်ပါက ကယ်လ်ဗင်အပူချိန် (Kelvin temperature) နှင့် ထုထည်သည် တိုက်ရိုက်အချိုးကျ ကြသည်။[၁]
တိုက်ရိုက်အချိုးကျမှုဆက်နွယ်မှုကို အောက်ပါအတိုင်း ရေးနိုင်သည်။
သို့မဟုတ်
အထက်တွင် ဖော်ပြခဲ့သည့် သင်္ကေတများမှာ -
- V = ဓာတ်ငွေ့၏ ထုထည်
- T = ဓာတ်ငွေ့၏ အပူချိန် (ကယ်လ်ဗင်ဖြငိ့ တိုင်းသည်။)
- k =ကိန်းသေ
ဤနိယာမသည် အပူချိန်တိုးလာပါက ဓာတ်ငွေ့၏ ထုထည်တိုးလာသည်ကို ပြ၏။ ဆန့်ကျင်ဖက်အနေဖြင့် အပူချိန် လျော့ကျသွားပါက ထုထည်လည်း လျော့ကျသွားသည်။ တူညီသည့် အရာဝတ္ထုကို မတူညီသည့် အခြေအနေနှစ်ခုတွင် နှိုင်းယှဉ်ခြင်းအတွက် နိယာမကို အောက်ပါအတိုင်း ရေးနိုင်သည်။
ညီမျှခြင်းတွင် ပကတိအပူချိန် တိုးပါက ဓာတ်ငွေ့၏ ထုထည်သည်လည်း အချိုးအစားတကျ တိုးလာသည်။
ရှာဖွေတွေ့ရှိမှုနှင့် အမည်ပေးပုံ
ပြင်ဆင်ရန်နိယာမ၏ အမည်သည် သိပ္ပံပညာရှင် Jacques Charles ကို အစွဲပြုကာ ပေးထားသည်။ Jacques Charles သည် မူလနိယာမကို ဖော်ထုတ်ခဲ့သည်။
ဓာတ်ငွေ့နှင့် အခိုးအငွေ့တို့သည် တိကျသောအပူချိန်အမှတ်နှစ်ခုအကြားတွင် တူညီသောပမာဏဖြင့် ပျံ့နှံ့ကြသည်ကို John Dalton က စမ်းသပ်ပြခဲ့၏။ ၁၈၀၂ ခုနှစ်၊ ဇွန်လ ၃၁ ရက်နေ့တွင် ပြင်သစ်လူမျိုး အတွေးအခေါ်သမား Joseph Louis Gay-Lussac က ရှာဖွေတွေ့ရှိမှုကို ပြင်သစ်အမျိုးသားတက္ကသိုလ်သို့ ပြသကာ အတည်ပြုခဲ့သည်။[၂] သူသည် ၁၇၈၀ ခုနှစ်များက ထုတ်ဝေခြင်းမရှိသည့် Jacques Charles ၏ အလုပ်ကို ချီးကျူးဂုဏ်ပြုခဲ့သည်။ အခြေခံစည်းမျည်းများမှာမူ Guillaume Amontons[၃] နှင့် Francis Hauksbee[၄] တို့က ရာစုနှစ်ခုအစောကာလကတည်းက ဖော်ပြခဲ့သည်။
Dalton က နိယာမသည် ပထမအကြိမ် လက်တွေ့ပြသခဲ့ရာတွင် ဓာတ်ငွေ့အားလုံးနှင့် အငွေ့ပြန်သောအရည်တို့၏ အခိုးအငွေ့တို့သည် ဆူမှတ်အထက် အပူချိန်တွင် အကျိုးသက်ရောက်သည်။[၅] Gay-Lussac ကလည်း ထိုအချက်ကို သဘောထား တူညီသည်။ ပြဒါးတိုင်ကဲ့သို့သော တိကျသည့် အရည်မှတ်နှစ်ခုဖြင့် တိုင်းတာပါက ထုထည်နှင့် အပူချိန်၏ ဆက်သွယ်မှုသည် linear function တစ်ခုအဖြစ် ပြသရန် မဖြစ်နိုင်ကြောင်း Gay-Lussac က ပြသခဲ့သည်။ Gay-Lussac သညိ linear အတိုင်းဆက်နွယ်မှုရှိသည်ဟု ဆိုသော မည်သည့်နိယာမကိုမှ လက်မခံကြောင်း စာတမ်းတွင် ရေးသားခဲ့သည်။ Dalton နှင့် Gay-Lussac တို့၏ အဓိကသုံးသပ်ချက်ကို သင်္ချာနည်းဖြင့် ရေးသားပါက -
အထက်တွင် ဖော်ပြခဲ့သည့် သင်္ကေတများမှာ -
- V100 = အပူချိန် ၁၀၀ °C တွင် ဓာတ်ငွေ့ပိုင်ဆိုင်သော ထုထည်
- V0 = အပူချိန် ၀ °C တွင် ဓာတ်ငွေ့ပိုင်ဆိုင်သော ထုထည်
- k = ကိန်းသေဖြစ်သည်။ တည်မြဲသော ဖိအားရှိသော ဓာတ်ငွေ့များတွင် တူညီသည်။
ဤညီမျှခြင်းတွင် အပူချိန်နှင့် ချားလ်စ်၏ နိယာမဟုသိလာမည့် အရာများ မပါဝင်ပေ။ Gay-Lussac ၏ k တန်ဖိုးသည် ( 1⁄2.6666) ဖြစ်သည်။ Dalton ၏ အစောပိုင်း တန်ဖိုးနှင့်လည်း ထပ်တူကျသည်။ လက်ရှိတန်ဖိုး ဖြစ်သည့် 1⁄2.7315 နှင့်လည်း နီးစပ်သည်။ ဤညီမျှခြင်းအတွက် Gay-Lussac သည် J. Charlesကို အသိအမှတ်ပြုခဲ့သည်။ ရေ၏ တိကျသောအမှတ်များရှိ ထုထည်ကိုသာမက အမှတ်နှစ်ခုကြားကိုပါတိုင်းတာခဲ့သည့် Dalton ၏ အတိုင်းအတာသည် Gay-Lussac ထက် ပိုမိုကျယ်ဝန်းသည်။
ကိုးကား
ပြင်ဆင်ရန်- ↑ Fullick၊ P. (1994)၊ Physics၊ Heinemann၊ pp. 141–42၊ ISBN 0-435-57078-1.
- ↑ Gay-Lussac, J. L. (1802)၊ "Recherches sur la dilatation des gaz et des vapeurs" [Researches on the expansion of gases and vapors]၊ Annales de chimie၊ 43: 137–175. English translation (extract).
On page 157, Gay-Lussac mentions the unpublished findings of Charles: "Avant d'aller plus loin, je dois prévenir que quoique j'eusse reconnu un grand nombre de fois que les gaz oxigène, azote, hydrogène et acide carbonique, et l'air atmosphérique se dilatent également depuis 0° jusqu'a 80°, le cit. Charles avait remarqué depuis 15 ans la même propriété dans ces gaz ; mais n'avant jamais publié ses résultats, c'est par le plus grand hasard que je les ai connus." (Before going further, I should inform [you] that although I had recognized many times that the gases oxygen, nitrogen, hydrogen, and carbonic acid [i.e., carbon dioxide], and atmospheric air also expand from 0° to 80°, citizen Charles had noticed 15 years ago the same property in these gases; but having never published his results, it is by the merest chance that I knew of them.) - ↑ See:
- Amontons, G. (presented 1699, published 1732) "Moyens de substituer commodément l'action du feu à la force des hommes et des chevaux pour mouvoir les machines" (Ways to conveniently substitute the action of fire for the force of men and horses in order to power machines), Mémoires de l’Académie des sciences de Paris (presented 1699, published 1732), 112–126; see especially pages 113–117.
- Amontons, G. (presented 1702, published 1743) "Discours sur quelques propriétés de l'Air, & le moyen d'en connoître la température dans tous les climats de la Terre" (Discourse on some properties of air and on the means of knowing the temperature in all climates of the Earth), Mémoires de l’Académie des sciences de Paris, 155–174.
- Review of Amontons' findings: "Sur une nouvelle proprieté de l'air, et une nouvelle construction de Thermométre" (On a new property of the air and a new construction of thermometer), Histoire de l'Academie royale des sciences, 1–8 (submitted: 1702 ; published: 1743).
- ↑ * Englishman Francis Hauksbee (1660–1713) independently also discovered Charles' law: Francis Hauksbee (1708) "An account of an experiment touching the different densities of air, from the greatest natural heat to the greatest natural cold in this climate," Archived 14 December 2015 at the Wayback Machine. Philosophical Transactions of the Royal Society of London 26(315): 93–96.
- ↑ Gay-Lussac (1802), from page 166:
"Si l'on divise l'augmentation totale de volume par le nombre de degrés qui l'ont produite ou par 80, on trouvera, en faisant le volume à la température 0 égal à l'unité, que l'augmentation de volume pour chaque degré est de 1 / 223.33 ou bien de 1 / 266.66 pour chaque degré du thermomètre centrigrade."
If one divides the total increase in volume by the number of degrees that produce it or by 80, one will find, by making the volume at the temperature 0 equal to unity (1), that the increase in volume for each degree is 1 / 223.33 or 1 / 266.66 for each degree of the centigrade thermometer.
From page 174:
" … elle nous porte, par conséquent, à conclure que tous les gaz et toutes les vapeurs se dilatent également par les mêmes degrés de chaleur."
… it leads us, consequently, to conclude that all gases and all vapors expand equally [when subjected to] the same degrees of heat.
| ဤ ရူပဗေဒနှင့် သက်ဆိုင်သော ဆောင်းပါးမှာ ဆောင်းပါးတိုတစ်ပုဒ် ဖြစ်သည်။ ဖြည့်စွက်ရေးသားခြင်းဖြင့် မြန်မာဝီကီပီးဒီးယားကို ကူညီပါ။ |


